Chemická oxidácia
Princíp
Základom procesu chemickej oxidácie je vytvorenie dostatočne silného oxidačného prostredia, pri ktorom sa zmení oxidačný stav/štruktúra kontaminujúcej látky. V rámci sanačných metód ex situ čistenia kontaminovaných vôd najčastejšie ide o oxidáciu organických látok pri súčasnom vzniku neškodných alebo menej toxických foriem (Anonym, 2002a). Chemická oxidácia ex situ sa zabezpečuje pridávaním oxidačných činidiel do chemických reaktorov. Kvôli zabezpečeniu homogénneho pôsobenia oxidačných činidiel sa obsah reaktora neustále premiešava. Príklad schémy procesu a usporiadania jednotlivých stupňov chemickej oxidácie je uvedený na obr. 4.2.39.
Použiteľnosť
Chemická oxidácia sa môže využiť pri širokom spektre najmä organických znečisťujúcich látok, ako sú amíny, fenoly, chlórfenoly, aldehydy, ropné uhľovodíky, monoaromatické uhľovodíky, halogénované alifatické uhľovodíky, polycyklické aromatické uhľovodíky, herbicídy, polychlórované bifenyly a iné, ale aj kyanidov, sulfidov, siričitanov a komplexov ťažkých kovov (Anonym, 1991; Eckenfelder et al., 1992; FRTR, 2008; Matějů – ed., 2006; Anonym, 2002a; Andreottola et al., 2008). Často sa využíva ako prípravný predstupeň pri čistení podzemných vôd znečistených ťažko biologicky degradovateľnými alebo toxickými látkami (Anonym, 2002a). V praxi je dôležitý správny výber oxidačného činidla a voľba dizajnu technologického zariadenia.
Základná charakteristika
Proces oxidácie je úzko prepojený s procesom redukcie, preto sa najčastejšie spoločne označujú ako oxidačno-redukčné procesy. Pri procese oxidácie pri úpravách znečistených vôd prebieha oxidácia znečisťujúcej látky (najčastejšie organickej látky – sú donorom elektrónov) na úkor redukcie oxidačného činidla (ktorý je akceptorom elektrónov). Príklad procesu degradácie fenolu ozonizáciou (oxidáciou ozónom) je uvedený v nasledujúcej reakcii (Wang et al., 2005):
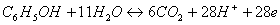 /x1 oxidácia fenolu,
/x1 oxidácia fenolu,
![]()
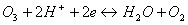 /x14 redukcia ozónu,
/x14 redukcia ozónu,
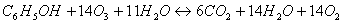 celková reakcia.
celková reakcia.
Napriek tomu, že oxidácia kontaminujúcich látok je z termodynamického hľadiska možná, pri praktických aplikáciách oxidačných procesov je potrebné zhodnotiť aj kinetické hľadisko, to znamená zhodnotiť rýchlosť danej reakcie, pričom je dôležité poznať aj tvorbu prípadných medziproduktov a ich reakčnú kinetiku. Ďalšou komplikáciou pri aplikáciách v praxi je vplyv fyzikálno-chemických vlastností čistenej vody, a to najmä teploty, pH, iónovej sily, prítomnosti katalyzátorov a inhibítorov atď.
Najčastejšie používané oxidačné činidlá sú Fentonovo činidlo (Fentonova reakcia), manganistan (draselný), peroxid vodíka, ozón, ultrafialové žiarenie, alkalická chlorácia a i. (Anonym, 2002a; Tchobanoglous et al., 2003; Liu a Lipták, 2000). Možné je však použiť aj kombináciu oxidačných činidiel (napr. UV/O3, UV/H2O2, Fenton/UV atď.), čo zvyšuje celkovú účinnosť oxidácie. Tieto kombinácie sa často využívajú pri pokročilých oxidačných metódach.
Fentonova reakcia (činidlo) sa vyznačuje relatívne rýchlym priebehom a vysokou účinnosťou. Fentonovo činidlo je vhodné na oxidáciu širokého rozsahu bežných kontaminantov vo vodách. Podstata Fentonovej reakcie je v katalytickom účinku iónov železa na kinetiku rozkladu peroxidu vodíka a tvorbu radikálov. Dôležitá je hodnota pH, ktorá by sa mala pohybovať v rozmedzí od 3 do 5. Hlavné reakcie prebiehajúce vo Fentonovom reakčnom systéme:
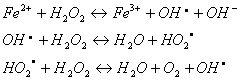
Samotný peroxid vodíka je možné využiť aj na oxidáciu niektorých oxidovateľných anorganických látok, ako sú sulfidy, kyanidy atď. Nevýhodou aplikácie peroxidu vodíka je však vysoká cena tohto oxidačného činidla, a preto sa využíva len v opodstatnených prípadoch.
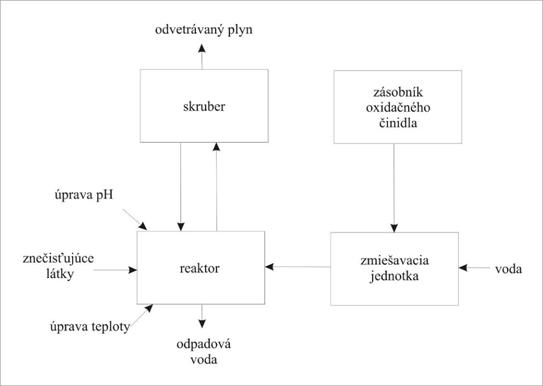
Obr. 4.2.39. Schéma procesu chemickej oxidácie.
Manganistan draselný je efektívny pri oxidácii tak v kyslých, ako aj v alkalických podmienkach. Manganistan draselný je možné využiť pri oxidácii niektorých organických látok (fenoly, benzonitrily, niektoré pesticídy), ako aj anorganických látok (kyanidy, sulfidy, železo atď.) (Wang et al., 2005).
Schopnosť relatívnej oxidácie niektorých organických znečisťujúcich látok je zhrnutá v tab. 4.2.18.
|
Schopnosť oxidácie |
Kontaminanty |
|
vysoká |
fenoly, aldehydy, amíny, niektoré zlúčeniny s obsahom síry |
|
stredná |
alkoholy, ketóny, organické kyseliny, estery, alkyl substituované aromáty, nitro substituované aromatické zlúčeniny, sacharidy (uhľohydráty) |
|
nízka |
halogénované uhľovodíky, nasýtené alifatické uhľovodíky, benzén |
Pri chemickej oxidácii špecifických organických zložiek nastáva zmena štruktúry, resp. degradácia oxidovanej látky. Podľa rozsahu degradácie a charakteru zmien je možné rozlíšiť niekoľko typov oxidácie špecifických látok (Rice, 1996):
• prvotná degradácia – nastávajú určité štrukturálne zmeny vo východiskových látkach,
• akceptovateľná degradácia – nastávajú také štrukturálne zmeny vo východiskových látkach, že sa zníži ich toxicita,
• definitívna, úplná degradácia (mineralizácia) – úplná zmena organického uhlíka na anorganický CO2,
• neakceptovateľná degradácia – nastávajú také štrukturálne zmeny vo východiskových látkach, že sa zvýši ich celková toxicita.
Pri aplikácii procesu oxidácie pri úprave kontaminovanej vody často nie je nutné robiť úplnú oxidáciu kontaminujúcich organických látok. V praxi je často postačujúca taká oxidácia, aby sa zvýšil stupeň biodegradability, alebo aby sa znížil stupeň toxicity. Následne je možné aplikovať ďalšie stupne (metódy) čistenia, napr. biologické. V každom prípade je však nutné vyhnúť sa neakceptovateľnej degradácii, pri ktorej vznikajú toxické medziprodukty zvyšujúce celkovú toxicitu čistenej vody.
Pri popise oxidačno-redukčných procesov a reakcií sa s úspešne využívajú niektoré chemicko-termodynamické charakteristiky, ako napr. oxidačno-redukčný štandardný elektródový potenciál polreakcie. Na základe výpočtov reakčných oxidačno-redukčných potenciálov polreakcií je možné uvažovať o charaktere priebehu rôznych oxidačno-redukčných reakcií.
Pri navrhovaní prevádzkovej technológie na realizáciu chemickej oxidácie znečistenej vody ex situ je potrebné správne zvoliť podmienky chemickej oxidácie (oxidačné činidlo, typ reaktora, čas zdržania, dávkovanie činidiel, chemicko-fyzikálne podmienky reakcie atď.). Dôležité je aj vykonanie laboratórnych a poloprevádzkových technologických testov pre daný typ kontaminovaných vôd. Na základe výsledkov testov je možné spresniť dávkovanie a podmienky procesu oxidácie. Termodynamické výpočty a zohľadnenie kinetiky prebiehajúcich reakcií napomáhajú stanoviť optimálne podmienky a rozsah reakcií a procesov. Správny dizajn reaktora, čas zdržania a v súvislosti s tým objem čistenej vody v pomere k činidlu sú najdôležitejšie podmienky správneho fungovania procesu (Wang et al., 2005).
V niektorých prípadoch je výhodné použiť tzv. pokročilé oxidačné metódy (Advanced oxidation processes), ktoré sú založené na vytváraní a využívaní voľného hydroxylového radikálu (HO·). Tento radikál sa vyznačuje vysokou oxidačnou kapacitou a dokáže degradovať (oxidovať) aj organické látky, ktoré nemôžu byť oxidované bežnými oxidačnými činidlami. Pri využití tohto radikálu prostredníctvom série oxidačných reakcií nastáva úplná oxidácia (mineralizácia) kontaminantu. Prostredníctvom voľných hydroxylových radikálov je možné úplne oxidovať prakticky akúkoľvek oxidovateľnú látku. Výhodou teda je, že pri čistení vody nevznikajú druhotné odpadové látky a nie je potrebná ani regenerácia (Tchobanoglous et al., 2003). Produkcia voľných hydroxylových radikálov sa zabezpečuje viacerými spôsobmi, napr. kombináciou niektorých oxidačných činidiel pri dodržaní špecifických fyzikálno-chemických podmienok, napr. ozón + UV (obr. 4.2.40), ozón + H2O2, UV + H2O2 + Fentonovo činidlo a iné. Nevýhodou týchto technológií je vyššia finančná náročnosť, ale praktické využitie sa rozširuje.
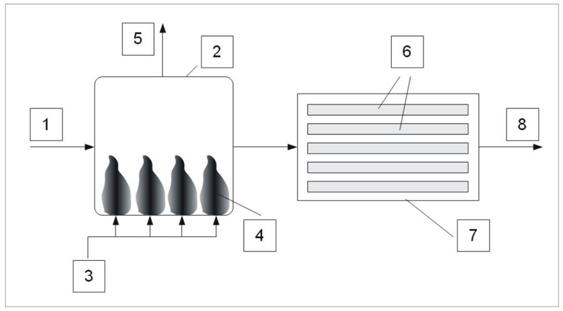
Vysvetlivky: 1 – vstup vody, 2 – ozónový kontaktný reaktor, 3 – generovanie ozónu, 4 – jemný bublinkový rozptylovač k zvýšeniu kontaktu ozónu s čistenou vodou, 5 – výstup ozónu do deštrukčnej tepelnej jednotky, 6 – UV lampa, 7 – UV reaktor, 8 – upravená odpadová voda.
Výhody a limitácie
Hlavné nevýhody je možné zhrnúť takto:
• nešpecifickosť metódy – pri čistení vody s vyšším obsahom organických látok, ktoré nie sú predmetom sanácie, sa v podstatnej miere zvyšuje spotreba oxidačného činidla (najmä, ak sú tieto látky náchylnejšie na oxidáciu);
• potenciálna možnosť výskytu tzv. neakceptovateľnej oxidácie, keď vznikajú nežiaduce toxické medziprodukty. Príčinou nedokonalej a nežiaducej oxidácie môže byť nedostatočné množstvo činidla, inhibícia oxidácie v dôsledku nevhodných hodnôt pH, nedostatočný čas kontaktu, nedostatočné miešanie (homogenizácia), prítomnosť vysokého množstva interferujúcich/konkurenčných látok schopných oxidácie (Anonym, 1991);
• relatívne vysoká finančná náročnosť a s tým súvisiaca vysoká potreba optimalizácie priebehu procesu oxidácie (Wang et al., 2005);
• v prípade využitia ultrafialového žiarenia na oxidáciu je nutný dobrý prestup žiarenia cez čistenú vodu (vysoká turbidita spôsobuje problémy);
• pri oxidácii prchavých organických látok (napr. s použitím UV/O3) môže nastať neželaný únik (prchanie) týchto látok namiesto plánovanej degradácie. V tomto prípade je potrebné použiť záchytné zariadenia na zachytenie unikajúcich kontaminantov;
• manipulácia so silnými oxidačnými činidlami vyžaduje špecifické bezpečnostné opatrenia;
• potenciálna tvorba organických halogénderivátov pri použití chlóru ako oxidačného činidla (Anonym, 2002a).
Výhody chemickej oxidácie vôd ex situ (Tchobanoglous et al., 2003; Wang et al., 2005):
• možnosť efektívne riadiť a ovplyvňovať priebeh chemickej oxidácie, a tak zvyšovať ekonomickú výhodnosť sanácie. Najjednoduchším riešením je online meranie hodnôt obsahu celkového organického uhlíka (TOC) a v závislosti od zistených hodnôt určovanie efektívneho dávkovania oxidačného činidla, času zdržania v reaktore, resp. dávkovania ďalších reaktantov či úpravy fyzikálno-chemických podmienok (napr. množstvo neutralizačného činidla);
• možnosť aplikovať pokročilé oxidačné metódy, ktoré sú efektívne aj pri vysoko nebezpečných, toxických a ťažko biologicky rozložiteľných látkach (napr. PCB);
• proces chemickej oxidácie sa môže úspešne kombinovať ako viacstupňový proces čistenia pri dosiahnutí optimálnych výsledkov.
Trvanie čistenia a účinnosť
Trvanie čistenia a účinnosť chemickej oxidácie úzko súvisí s použitým oxidačným činidlom a s typom kontaminujúcej látky (Tchobanoglous et al., 2003; Wang et al., 2005). Pri vhodne zvolenom oxidačnom činidle a technologickom postupe je chemická oxidácia pomerne rýchla metóda a celkové trvanie sanácie je limitované skôr možnosťami extrakcie znečisťujúcej látky z horninového prostredia prostredníctvom sanačného čerpania.
Z ekonomického hľadiska môže byť táto metóda pomerne finančne nákladná. Finančná náročnosť sa prejavuje najmä pri veľmi vysokom obsahu oxidovateľných látok (najmä balastných, čiže nie cieľových látok) v čistenej vode. Prejavuje sa to vysokou spotrebou oxidačných činidiel (Wang et al., 2005).
© Atlas sanačných metód environmentálnych záťaží
Autori: Jana Frankovská, Jozef Kordík, Igor Slaninka, Ľubomír Jurkovič, Vladimír Greif,
Peter Šottník, Ivan Dananaj, Slavomír Mikita, Katarína Dercová a Vlasta Jánová
Štátny geologický ústav Dionýza Štúra, Bratislava 2010, 360 s,
ISBN 978-80-89343-39-3