Použitie nanočastíc železa
Princíp
Veľkosť nanočastíc železa sa pohybuje v rozsahu od 10 do 100 nanometrov a jeho vlastnosti vo veľkej miere závisia od procesu ich výroby (Miehr, 2004).
Nanočastice elementárneho železa (nZVI) fungujú ako silné redukčné činidlo. Železo (Fe) je prirodzená zložka životného prostredia, a preto pri jeho použití pri sanáciách in situ sa nevnáša do prostredia cudzorodá alebo toxická látka. Prvá aplikácia tejto perspektívnej sanačnej metódy sa uskutočnila v Českej republike už pred šiestimi rokmi (Mace, 2006). Na území USA sa laboratórne skúšky začali overovať v teréne už v roku 2000. Jeden z prvých pilotných testov použitia nanočastíc na báze železa na území USA z roku 2002 opisuje Zhang (2003).
Nanomateriály/častice kovového železa alebo oxidy železa (ferity – magnetit, hematit, goethit) predstavujú novú generáciu sanačných materiálov, ktoré môžu zabezpečiť pomerne lacné riešene aj najzložitejších antropogénnych znečistení. Veľký merný povrch a povrchová aktivita zabezpečuje enormnú flexibilitu pri ich aplikácii v systémoch čistenia podzemných vôd a pôd (Zhang, 2003). Veľký špecifický povrch zlúčenín Fe a ich chemická povrchová reaktívnosť podmieňuje schopnosť špecificky sorbovať rozličné rozpustné látky (ťažké kovy, polokovy, oxoanióny, napr. fosfáty). Železo sa vyzráža vo forme okrov, ktoré majú environmentálny význam, pretože majú prirodzenú tendenciu viazať na seba kontaminanty z roztokov. Prirodzená tendencia ťažkých kovov prechádzať cez vyzrážanie a sorpciu do okrov sa môže využiť pri čistení odpadových vôd v komerčných úpravníckych systémoch. Formovanie týchto minerálov silne ovplyvňujú biologické a chemické parametre. Hoci tieto okre pokrývajú povrch organizmov a pôd, nemusia mať na ne len zlý vplyv, ale môžu sa využiť na efektívne upravovanie kontaminovaných vôd v rezervoároch, záchytných bazénoch a konštruovaných močiaroch (Hedin a Nair, 1994).
Použiteľnosť
Využitie nanoželeza pri sanácii znečistených území patrí v súčasnosti k najpokrokovejším sanačným metódam, ktoré môžu poskytnúť finančne výhodné riešenie najvýraznejších problémov spojených so znečistením životného prostredia. Nanočastice Fe vďaka veľkému mernému povrchu a veľkej povrchovej reaktivite poskytujú pri aplikáciách in situ enormnú flexibilitu. V súčasnosti sa táto technológia použila na 37 lokalitách v USA, z toho v 48 % prípadov sa použili nanočastice elementárneho železa (nZVI) a v 11 % prípadov emulgované nanočastice elementárneho železa (Karn et al, 2009). Aplikácie v Európe sú zatiaľ zastúpené menej (Observatory Nano report, 2010). V Českej republike prebiehajú v súčasnosti dve plné aplikácie nanoželeza pre sanácie chlórovaných etylénov (Černík, 2010).
Laboratórne aj terénne štúdie z posledných rokov preukázali, že nZVI je veľmi účinné pri odstraňovaní viacerých kontaminantov vyskytujúcich sa v podzemných vodách vrátane perchlóreténu (PCE), trichlóreténu (TCE) a PCB (Lien, 2001), tetrachlórmetánu, trinitrotoluénu (TNT), organohalogénovaných pesticídov, dusičnanov a ťažkých kovov (napríklad chróm a olovo). Príklady použitia tejto sanačnej metódy sú podrobne uvedené v publikáciách a dokumentoch US EPA.
České aj iné zahraničné skúsenosti ukázali, že sanačné metódy s využitím nanočastíc železa sú veľmi účinné pri transformácii a znižovaní toxicity veľkého množstva znečisťujúcich látok (rozličné chlórované uhľovodíky, PCB, dusičnany, dusitany a migračné formy ťažkých kovov Cr, As, Ni a Hg vrátane niektorých rádionuklidov) (Černík a Kvapil, 2006, Černík 2010). Laboratórne sa preukázala dostatočná redukčná účinnosť metódy pri viac ako 80 typoch kontaminantov (MŽP ČR, 2007). Najväčšia pozornosť sa v súčasnosti venuje odstraňovaniu chlórovaných uhľovodíkov, najmä chlórovaných etylénov.
Výhody použitia nanoželeza pri odstraňovaní chlórovaných uhľovodíkov oproti väčším železným časticiam sú predovšetkým tieto (Černík, 2010):
• pohyblivosť častíc v podzemnej vode oproti statickej reaktívnej stene,
• pomerne jednoduchá aplikácia do vrtov,
• veľký merný povrch a vysoká reaktivita,
• rýchlosť rozkladných reakcií chlórovaných uhľovodíkov je výrazne vyššia,
• vzniká oveľa menej nižších chlórovaných uhľovodíkov a tieto medziprodukty sa ďalej odbúravajú, väčšinou dochádza ku priamej redukcii na etán a etén,
• častice sú dostatočne stabilné a zostávajú reaktívne v horninovom prostredí po dlhý čas.
Základná charakteristika
Existuje niekoľko viac či menej náročných spôsobov prípravy nanoželeza. Najpoužívanejší postup laboratórnej prípravy je redukcia vodného 1M–FeCl3.6H2O postupným prikvapkávaním 1,6 M–NaBH4 pri izbovej teplote a za stáleho miešania. Túto metódu prvýkrát publikovali Wang a Zhang v roku 1997. Reakcia prebieha podľa rovnice:
Fe(H2O)63+ + 3BH4 - + 3H2O → Fe0 + 3B(OH)3 + 10.5H2
Merný povrch nZVI určený metódou BET bol stanovený na 28,8 m2/g (Okinaka, 2004) až 35,5 m2/g (Wang a Zhang, 1997).
Vzdialenosť OH – OH v mineráloch Fe sa veľmi dobre zhoduje s usporiadaním polyédrov stopových prvkov, preto hydroxylové skupiny tvoria ideálne formy na zachytenie stopových prvkov. Chemická podstata a vysoký špecifický povrch submikroskopických čiastočiek oxidov Fe z nich robí účinné sorbenty:
• anorganických aniónov, ako sú silikáty, fosfáty a molybdenity,
• organických aniónov a molekúl, ako sú citrány, fulvokyseliny, humídne kyseliny a biocídy,
• katiónov, ako sú Al, Cu, Pb, V, Zn, Co, Cr a Ni.
Na povrchu železných nanočastíc prebieha redukčný rozklad chlórovaných uhľovodíkov na báze metánu, etánu, etylénu, benzénu a polychlórovaných uhľovodíkov. Pri tomto rozklade pôsobí Fe0 ako donor elektrónov a chlórovaný uhľovodík, ktorý je z pohľadu reakcie redukovanou zlúčeninou, ako akceptor elektrónov. Pri tejto reakcii sa chlórované uhľovodíky transformujú na menej toxické zlúčeniny.
Okrem Fe-nanomateriálov prirodzene vznikajúcich vyzrážaním železitých okrov sa v súčasnosti využívajú čistiace technológie založené na využití vznikajúcich oxyhydroxidov reakciou kontaminovaných vôd v priepustných bariérach obsahujúcich elementárne nanoželezo (zero valent iron, Fe0). Pri týchto metódach sa využívajú rôzne tvarové a veľkostné formy Fe0 – od práškovej formy cez guľôčky až po úlomky (čipsy) (obr. 4.4.1). Táto veľkostná a tvarová variabilita súvisí s požiadavkou navrhovania priepustných bariér. Je potrebné, aby mala bariéra rovnakú priepustnosť ako okolité prostredie a aby tak nedochádzalo k zmenám rýchlosti prúdenia kontaminovaných médií.
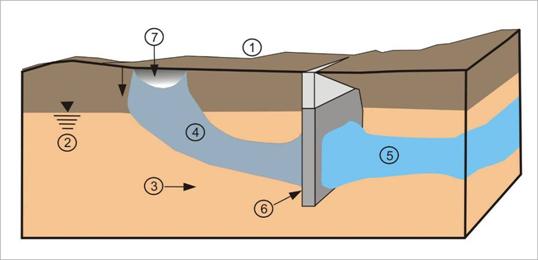
Obr. 4.4.1. Formy elementárneho Fe používané pri reaktívnych bariérach.
Vysvetlivky: 1 – terén, 2 – hladina podzemnej vody, 3 – smer prúdenia podzemnej vody, 4 – kontaminačný mrak, 5 – vyčistená voda, 6 – priepustná reaktívna bariéra s obsahom elementárneho železa, 7 – zdroj znečistenia.
Donedávna sa hydroxidy Fe z mineralogického hľadiska opisovali ako amorfné. Vyplývalo to z toho, že oxidácia a hydrolýza Fe vedie k vyzrážaniu extrémne malých častíc (≤ 10 nm). Väčšina okrov je mineralogickým komplexom, ktorý na svoju identifikáciu vyžaduje kombináciu selektívnych chemických extrakčných metód a technických postupov. Najčastejšie minerály vyskytujúce sa v okroch sú:
• goethit,
• ferihydrit,
• schwertmannit,
• jarosit.
Výskumom sa zistilo, že goethit sa vyskytuje v celom rozpätí sledovaných hodnôt, ale dominantným komponentom je len vtedy, ak hodnota pH je vyššia ako 6. Ferihydrit sa formuje na prechode od kyslých do alkalických podmienok. To potvrdzuje predchádzajúce štúdie banských vôd. Naopak, jarosit sa vyskytuje a zostáva stabilným iba vo veľmi silno acidných podmienkach (pH < 3). Najčastejšie sa vyskytujúci minerál okrov je schwertmannit. Nachádzal sa vo väčšine študovaných vzoriek, ale najvhodnejšia hodnota pH na jeho formovanie je od 3 do 4.
Ďalším dôležitým faktorom pri formovaní okrov je obsah síranov vo vodách. Výsledkom laboratórnych pokusov bolo zistenie, že najvhodnejší obsah síranov na kryštalizovanie jarositu je viac ako 3 000 μm/L. Na formovanie schwertmannitu je najvhodnejšia koncentrácia síranov v rozsahu od 1 000 do 3 000 μm/L. Pri formovaní goethitu či ďalších hydroxidov Fe (napr. lepidokrokit) nie je SO4 štruktúrnym komponentom. Prítomnosť síranov v podmienkach, v ktorých sa vyskytuje ferihydrit, vedie k jeho rapídnej transformácii na goethit (Bigham et al., 1992; Auerswald et al., 1998).
Ťažké kovy sa absorbujú goethitom v poradí Cu > Pb > Zn > Cd > Ni > Mn, pre hematit platí zmenené poradie v pozícii Cu a Pb. Najdôležitejším faktorom, ktorý určuje mieru adsorpcie, je hodnota pH. Strmý nárast adsorpcie možno pozorovať v rámci úzkeho rozsahu pH. Tento rozsah hodnôt pH je špecifický pre daný kov. Zistilo sa, že hodnoty pH pri maximálnom zvýšení adsorpcie sú lineárne závislé od prvej hydrolyzačnej konštanty kovu K1 = (MOH+) / (M2+) . (OH–). Z toho vyplýva, že hydrolyzovaná zlúčenina (MOH+) v porovnaní s nehydrolyzovanou (M2+) sa absorbuje prednostne.
Štruktúra povrchového komplexu medzi funkčnými skupinami oxidov Fe a ťažkými kovmi nie je úplne známa. Na základe miery uvoľnenia jedného alebo dvoch protónov sa predpokladá, že reakciami sa môžu tvoriť mono- (1) alebo binukleárne (2) komplexy:
Fe – OH + M2+ à Fe – O – M+ (1)
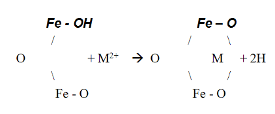 (2)
(2)
Ak hodnota pH systému vzrastie, MOH+ hydroxozlúčeniny sa budú absorbovať skôr ako M2+:
Fe – OH + M2+ + H2O à Fe – O – MOH + 2H+
Silná závislosť absorpcie ťažkých kovov od hodnôt pH je veľmi dôležitá pre mobilitu toxických prvkov v pôdnom pokryve. Táto skutočnosť je osobitne závažná v spojitosti s dokumentovanou acidifikáciou pôd v priemyselných oblastiach. Zistil sa aj vplyv rôznych aniónov na adsorpciu ťažkých kovov, ktorý možno vysvetliť tvorbou iónových párov, napr. MCl+. Takéto iónové páry môžu byť prednostne absorbované pred M+.
Ďalšie dva faktory, ktoré ovplyvňujú adsorpciu ťažkých kovov na hydroxidy Fe, sú čas a teplota. Zistila sa lineárna závislosť medzi adsorpciou Ni, Zn, Cd a goethitom a druhou mocninou času. To indikuje, že pri adsorpcii sa uplatňuje difúzny proces (Dixon a Weed, 1989). Difúzia môže byť riadiacim faktorom rýchlosti, keď sa kov dostáva do mikropórov kryštálu. Tento proces sa urýchľuje so vzrastajúcou teplotou. To vysvetľuje, prečo sa adsorpcia kovov zvyšuje v rozpätí od 5 do 35 ºC. Migrácia do mikropórov môže byť vysvetlením, prečo v niektorých prípadoch významné množstvo absorbovaného ťažkého kovu sa môže len veľmi ťažko reextrahovať, najmä pri použití silných kyselín.
Vzhľadom na minimálnu veľkosť častíc sa tvoria suspenzie alebo koloidné fázy, ktoré pomaly sedimentujú na dno nádrží alebo sú transportované tokom. Tento princíp umožňuje čistenie toxických kyslých a alkalických vôd v technológiách in situ (oxidačno-redukčných, neutralizačných), ale aj zníženie koncentrácie prvkov v prírodných a úžitkových vodách.
Nanočastice elementárneho železa sa môžu použiť aj v rôznych modifikáciách, napríklad ako emulzia s rastlinným olejom (Quinn, 2005; Klimková et al, 2010). Nanočastice elementárneho železa stabilizované vo vodno-olejnatej emulzii sa označujú symbolom EZVI. Nanoželezo od firmy TODA sa označuje symbolom RNIP. Nanočastice sa vyrábajú v redukčnej peci s následným mletím v roztoku. Merný povrch RNIP je približne 20 m2/g, s prevažujúcim rozmerom častíc 80 nm (Kvapil a Černík, 2009).
Účinnosť
Účinnosť sanačnej metódy priamo závisí od kvality použitého nanomateriálu. Posledné skúsenosti a perspektívy využitia elementárneho nanoželeza zhrnuli Kvapil a Černík (2009). Príčiny, pre ktoré táto metóda napriek úspešným laboratórnym skúškam nie je zaradená medzi bežne používané, štandardné sanačné metódy, zhrnuli takto:
1. obmedzená mobilita a z toho vyplývajúci malý polomer dosahu aplikačných vrtov,
2. vysoká cena produktu,
3. stále pomerne malý počet úspešných aplikácií a z toho vyplývajúci malý počet referencií.
Na základe projektu AV ČR Výzkum výroby a použití nanočastic za bázi nulmocného železa pro sanace kontaminovaných podzemních vod v rámci úlohy Nanotechnologie pro společnost sa testovali rôzne spôsoby výroby nanočastíc za rôznych podmienok. Na základe tohto projektu sa vyvinulo nanoželezo označené obchodným názvom NANOFER-25, ktoré v súčasnosti vyrába firma NANOIRON, s. r. o. Toto nanoželezo sa vyrába v redukčnej atmosfére suchou cestou (podobne ako TODA), ale z prekurzora a za podmienok zaručujúcich nanorozmery výsledného produktu bez potreby dodatočného mletia. Povrchové vlastnosti sa modifikujú prídavkami rozličných povrchovo aktívnych látok.