Chemická oxidácia
Princíp
Princíp chemickej oxidácie in situ (ISCO) spočíva v infiltrácii vodného roztoku oxidačného činidla do horninového prostredia tak, aby nastala deštrukcia kontaminujúcich látok rozpustených v podzemnej vode, sorbovaných v horninovom prostredí alebo prítomných vo forme voľnej fázy (Kubal et al., 2008).
Použiteľnosť
Technológia chemickej oxidácie sa používa na sanáciu pásma nasýtenia aj pásma prevzdušnenia horninového prostredia, a to na odstraňovanie akéhokoľvek kontaminantu, ktorý je oxidovateľný za vzniku netoxických alebo menej toxických produktov. Väčšina doteraz realizovaných aplikácií bola smerovaná do pásma nasýtenia na lokalitách kontaminovaných organickými látkami s relatívne vyššou rozpustnosťou. Sanácia chemickou oxidáciou sa najčastejšie uvádza v súvislosti so sanáciou pásma nasýtenia kontaminovanej chlórovanými eténmi. Ďalšie často spomínané cieľové kontaminanty sú benzén, toluén, etylbenzén a xylény, polyaromatické uhľovodíky, polychlórované bifenyly, chlórbenzény a ďalšie. Dosiaľ neexistujú všeobecné zjednodušujúce kritériá, na základe ktorých by bolo možné aspoň odhadnúť použiteľnosť chemickej oxidácie na lokalitách s určitým typom kontaminácie alebo s určitými charakteristikami horninového prostredia. Niektoré kritériá sú naznačené v odbornej literatúre (Kubal et al., 2008).
Praktické používanie chemickej oxidácie in situ je veľmi rozšírené a akceptované mnohými štátnymi kontrolnými orgánmi v Amerike, Ázii aj Európe. Medzi najčastejšie používanými metódami pri sanáciách starých záťaží v USA sa ISCO zaraďuje na tretie miesto. Prvé aplikácie ISCO pri čistení kontaminovaných lokalít sa realizovali už koncom 80. rokov minulého storočia. Používanie sa rýchlo rozšírilo v 90. rokoch, keď sa na základe validačných štúdií federálnych úradov preukázalo, že chemická oxidácia in situ je účinná a dobre aplikovateľná sanačná technológia, najmä v spojení s ďalšími sanačnými technikami ako biologické dočistenie, vákuová extrakcia pôdneho vzduchu (venting), aerácia (airsparging) (vháňanie vzduchu pod hladinu podzemnej vody, stripovanie kontaminantov do pásma prevzdušnenia a ich následné odvádzanie prostredníctvom odsávacích vrtov) a pod. Ukázalo sa, že aj napriek úvodným vysokým finančným nákladom na vybudovanie zariadení na aplikáciu oxidačného roztoku do horninového prostredia ide v mnohých prípadoch o výhodnú sanačnú techniku. Konkrétne údaje o type kontaminantu a podmienkach na lokalite je možné získať z rôznych zdrojov, napríklad na webových stránkach Agentúry na ochranu životného prostredia USA (US EPA). Oxidovateľnosť niektorých organických znečisťujúcich látok je uvedená v tab. 4.1.2.
Tab. 4.1.2. Oxidovateľnosť niektorých organických kontaminantov (TOSC, 2004).
|
Oxidovateľnosť |
Znečisťujúce látky |
|
vysoká |
fenoly, aldehydy, amíny, niektoré zlúčeniny síry |
|
stredná |
alkohol, ketóny, organické kyseliny, uhľovodíky, estery, aromatické uhľovodíky |
|
nízka |
vyššie chlórované uhľovodíky, nasýtené alifatické zlúčeniny |
Základná charakteristika
Medzi najčastejšie používané činidlá ISCO patrí najmä ozón (obr. 4.1.6), manganistan draselný/sodný, peroxid vodíka alebo Fentonovo činidlo. Fentonovo činidlo je peroxid vodíka zmiešaný s kovovým katalyzátorom (najčastejšie so železom) (TOSC, 2004). Niektorým ďalším, potenciálne použiteľným oxidačným činidlám bola venovaná skôr okrajová pozornosť. Ako príklady môžeme uviesť peroxodisíran a rozpustený kyslík. Koncovými produktmi prebiehajúcich reakcií sú (podľa použitého oxidačného činidla) oxid uhličitý, voda, bežné zlúčeniny železa a oxidy mangánu, teda látky, ktoré sú v prírode obvyklé.
Manganistan draselný sa môže použiť na deštrukciu rozličných organických látok, napríklad aromátov, fenolov, pesticídov a organických kyselín. Praktické skúsenosti sú v prípade týchto látok stále pomerne obmedzené. Výsledným produktom redukcie manganistanu sú málo rozpustné oxidy mangánu (kvôli jednoduchosti uvedené ako MnO2), ktoré dodatočne zvyšujú sorpčnú kapacitu horninového prostredia (niekedy významne). V prípade tetrachlóreténu (C2Cl4) prebieha deštrukčná reakcia podľa rovnice (Matějů et al., 2006):
4 KMnO4 + 3 C2Cl4 + 4 H2O → 6 CO2 + 4 K+ + 4 MnO2 + 12 Cl– + 8 H+.
V prípade peroxidu vodíka je jeho deštrukčný účinok na organické kontaminanty sprostredkovaný hydroxylovými radikálmi, ktoré z peroxidu vodíka prechodne vznikajú. Ich tvorbu podporuje prítomnosť železnatých iónov (Fe2+), pričom zmes peroxidu vodíka a železnatých iónov býva označená ako Fentonovo činidlo (Matějů et al., 2006):
H2O2 + Fe2+ → Fe3+ + OH° + OH–.
Ak je ako kontaminantom tetrachlóretén, potom princíp jeho deštrukcie peroxidom vodíka naznačuje zjednodušená rovnica (Matějů et al., 2006):
2 H2O2 + C2Cl4 → 2 CO2 + 4 HCl.
Často sa uvádza, že peroxid vodíka je vhodný na sanáciu chlórovaných aromatických rozpúšťadiel, polyaromatických uhľovodíkov a ropných produktov. V prípade Fentonovho činidla je zásadnou otázkou jeho správna príprava. Toto činidlo musí byť stabilné po celý čas vsakovania. Na jeho stabilitu má zásadný vplyv hodnota pH a teplota. Zrejmou nevýhodou je potreba jeho prípravy na mieste použitia (Matějů et al., 2006).
Ozón je rovnako ako peroxid vodíka a manganistan silné oxidačné činidlo. Oxiduje organické kontaminanty dvoma spôsobmi: priamou oxidáciou alebo pomocou tvorby voľných prechodných radikálov (druhý spôsob oxidácie je rýchlejší). Nasledujúca rovnica ukazuje súhrnnú reakciu ozónu s tetrachlóreténom vo vode (Matějů et al., 2006):
2 O3 + 2 H2O + C2Cl4 > 2 CO2 + 4 HCl + 2 O2.
Použitie ozónu sa najčastejšie spomína v súvislosti so sanáciou chlórovaných rozpúšťadiel a polyaromatických uhľovodíkov. Vzhľadom na jeho vysokú reaktivitu a nestabilitu sa musí vyrábať priamo na lokalite.
Z uvedených oxidačných činidiel má zatiaľ najväčší praktický význam manganistan draselný. Používa sa vo forme vodného roztoku, ktorého koncentrácia sa spravidla pohybuje v rozmedzí 20 – 30 g . l–1.
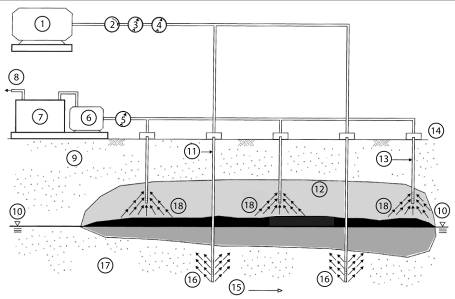
Obr. 4.1.6. Všeobecná schéma ozonizácie pásma nasýtenia in situ.
Vysvetlivky: 1 – kompresor vzduchu (ozónu), 2 – regulátor, 3 – tlakomer, 4 – prietokomer, 5 – vákuometer, 6 – vákuová pumpa, 7 – jednotka na úpravu a ošetrenie plynov (plynová čistiaca jednotka), 8 – uvoľňovanie plynov, 9 – horninové prostredie – pásmo prevzdušnenia, 10 – hladina podzemnej vody, 11 – vrt na injektovanie vzduchu, 12 – znečistená zemina, 13 – vrt na extrakciu vzduchu, 14 – úroveň/povrch terénu, 15 – smer prúdenia podzemnej vody, 16 – injektáž vzduchu (kyslíka), 17 – pásmo nasýtenia, 18 – prúdenie pár/výparov.
Výhody a limitácie
Chemickú oxidáciu in situ je možné v rámci procesu sanácie environmentálnych záťaží použiť ako moderný, relatívne rýchly a účinný postup pri odstraňovaní znečistenia na lokalite. Dôležité je zváženie vhodnosti metódy vzhľadom na prítomný kontaminant v horninovom prostredí. Limitujúcim faktorom sú charakteristiky lokality. Hlavný ukazovateľ, ktorý môže vylúčiť jej zamýšľané použitie, je obsah prirodzene sa vyskytujúcich organických látok, vyjadrený ako obsah organického uhlíka v danej matrici. Vplyv tohto parametra na spotrebu manganistanu draselného bol preukázaný a kvantifikovaný. Hlavné výhody chemickej oxidácie in situ sú (Fuentes et al., 2002; ITRC, 2005):
• relatívne rýchly priebeh deštrukcie kontaminantov,
• tvorba netoxických produktov,
• malé množstvo odpadu, ktoré pri aplikácii metódy vzniká.
Všeobecnou nevýhodou chemickej oxidácie in situ je nutnosť dodržiavať pomerne prísne bezpečnostné pravidlá vzťahujúce sa na nakladanie s oxidačnými činidlami. Komplikácie môžu nastať jednak v prípade, keď použitie oxidačného činidla znamená pre lokalitu neúmerne vysoké riziko z pohľadu ochrany ľudského zdravia, jednak vtedy, ak pri vsakovaní oxidačného činidla môže nastať jeho únik mimo priestoru sanačného zásahu.
Často sa vyskytujúca nadmerná spotreba oxidantu v prípade neprítomnosti prirodzených organických látok v prostredí viedla k realizácii korelačnej a multivariačnej analýzy medzi pozorovanou špecifickou spotrebou manganistanu draselného a celým radom fyzikálno-chemických charakteristík skúmaných matríc. Zatiaľ sa spoľahlivo nenašli parametre, ktoré by mali na túto spotrebu priamy vplyv. V rámci laboratórnych experimentov sa pri oxidačných reakciách nedosiahla rovnováha. To odráža možnosť manganistanu draselného reagovať s vodou za katalytického účinku prítomných oxidov mangánu. Tento jav môže byť závažný z hľadiska praktickej aplikácie chemickej oxidácie in situ (Kubal et al., 2008).
Trvanie čistenia a účinnosť
Čas, ktorý si vyžaduje použitie chemickej oxidácie, závisí od reaktivity kontaminantov s oxidantmi, od veľkosti a hĺbky kontaminovanej zóny, rýchlosti a smeru prúdenia podzemných vôd, pôdneho typu a podmienok na kontaminovanej lokalite. Vo všeobecnosti je však chemická oxidácia rýchlejšia ako iné metódy in situ. Časový rozsah sa pohybuje zvyčajne v mesiacoch, menej často v rokoch (TOSC, 2004).
© Atlas sanačných metód environmentálnych záťaží
Autori: Jana Frankovská, Jozef Kordík, Igor Slaninka, Ľubomír Jurkovič, Vladimír Greif,
Peter Šottník, Ivan Dananaj, Slavomír Mikita, Katarína Dercová a Vlasta Jánová
Štátny geologický ústav Dionýza Štúra, Bratislava 2010, 360 s,
ISBN 978-80-89343-39-3